Jurnal Ilmu dan Teknologi Hasil Ternak, April 2016, Hal 1-7 Vol. 11, No.1
ISSN: 1978 – 0303
KADAR LOW DENSITY LIPOPROTEIN DAN GAMBARAN HISTOPATOLOGI HEPAR PADA TIKUS MODEL DIABETES MELLITUS TIPE 1 DENGAN PEMBERIAN EKSTRAK ETANOL Curcuma Longa L
Herlina Pratiwi, Djoko Winarso dan Nunung Handoyo
Program Studi Pendidikan Dokter Hewan Fakultas Kedokteran Hewan Universitas Brawijaya
#Email: herlinapratiwi.drh@gmail.com
ABSTRACT
This study was conducted to determine levels of LDL and liver damage in rats (Rattus norvegicus) models of type 1 diabetes mellitus inducted by streptozotocin (STZ) with etanol extract of turmeric (Curcuma Longa L) therapy. Animals used rat (Rattus norvegicus) 3-month-old males who were divided into 5 groups, each group consisting of four mice. The group was divided according to treatment: negative control (not induced by STZ), the positive control group (STZ induced), groups of rats DM 1 with etanol turmeric extract therapy a dose of 1.2 g / kg, groups of rats DM 1 with etanol turmeric extract therapy a dose of 1.8 g / kg, and groups of rats DM 1 with etanol turmeric extract therapy a dose of 2.7 g / kg. LDL levels measured by direct method and the severity of liver damage was observed through histopatology picture. The results showed that the etanol extract of turmeric dose of 2.7 g / kg in a rats model of type 1 diabetes mellitus can lower LDL levels up to 59.55%, and reduced the severity of fatty liver with reduced fat vacuoles. The conclusion from this study that the etanol extract of turmeric contains antioxidants that can lower LDL levels and reduced the severity of fatty liver in type 1 diabetes mellitus.
Keywords: Diabetes mellitus type 1, etanol extract of turmeric, Histopathology of liver and LDL
PENDAHULUAN
Diabetes mellitus (DM) merupakan penyakit gangguan metabolisme karbohidrat yang gejala umumnya berupa hiperglikemia. Diabetes mellitus tipe 1 (DM tipe 1) atau Insulin Dependent Diabetes Mellitus (IDDM) adalah salah satu tipe diabetes yang tergantung pada produksi insulin atau terjadi karena adanya kerusakan pada sel β pankreas yang memproduksi insulin (Mayfield,1998). Faktor – faktor yang dapat memicu terjadinya diabetes pada hewan, antara lain umur, jenis kelamin, ras, dan lingkungan (Fall et al., 2007). Prevalensi kejadian Diabetes mellitus pada manusia menurut International Diabetes Federasion adalah 8,39%. Diabetes mellitus (DM) pada hewan terjadi pada pet animal seperti anjing dan kucing, hal ini disebabkan oleh pemberian pakan yang tinggi lemak maupun pemberian pakan melebihi kebutuhan tubuhnya. Menurut Fall et al. (2007), terjadi 13 kasus DM per 10.000 anjing tiap tahunnya pada anjing umur lebih dari lima tahun dan ras yang sering mengalami DM adalah Australian Terriers, Samoyeds, Swedish Elkhounds dan Swedish Lapphunds. Hoenig (2002) menyebutkan bahwa pada kucing prevalensi kejadian DM sebesar 0,5%, faktor yang mempengaruhi adalah obesitas, umur, jenis kelamin, dan sterilisasi (Hoenig, 2002).
Menurut Wijaya (1995), penurunan sekresi insulin dalam penyakit DM tipe 1 mengakibatkan metabolisme karbohidrat, protein dan lemak terganggu. Lemak dalam darah terdiri dari kolesterol, trigliserida, fosfolipid, dan asam lemak bebas. Defisiensi insulin menyebabkan peningkatan Hormone Sensitive Lipase (HSL), penurunan Lipoprotein Lipase (LPL) dan gangguan metabolisme lemak yang mengakibatkan kadar Low Density Lipoprotein (LDL) meningkat dan kerusakan hepar akibat peningkatan trigliserida. Peningkatan LDL dalam tubuh yang berlebihan dapat meningkatkan kadar radikal bebas di dalam tubuh, sehingga perlu diberikan antioksidan eksternal untuk bisa menstabilkannya. Antioksidan eksogen bisa didapatkan diantaranya dari kunyit.
Kunyit diketahui memiliki keunggulan sebagai antioksidan karena kandungan kurkuminnya. Kurkumin dapat berperan sebagai antioksidan dan mampu menurunkan radikal bebas karena mengandung senyawa fenolik (Priyadarsini et al., 2003). Kurkumin sebagai antioksidan dapat menghambat peningkatan Reactive Oxygen Species (ROS) dengan menurunkan enzim xanthine oksidase yang berlebihan. Penurunan ROS menghambat kerusakan sel β pankreas, sehingga terjadi peningkatan sekresi insulin. Sekresi insulin meningkat juga disebabkan karena aktivitas kurkumin sebagai antioksidan dengan cara merangsang sekresi pankreas untuk menghasilkan hormon insulin (Setiawan dan Ernawati, 2007). Peningkatan sekresi insulin dapat membuat proses lipolisis kembali normal sehingga dapat menurunkan kadar Low Density Lipoprotein (LDL) dan kadar trigliserida, sehingga dapat mengurangi terjadinya kerusakan pada hepar. Dari penjelasan di atas, penelitian ini bertujuan untuk mengetahui pengaruh kurkumin sebagai terapi pada tikus (Rattus norvegicus) model diabetes mellitus tipe 1 hasil induksi streptozotocin (STZ) terhadap kadar Low Density Lipoprotein (LDL) dan mengetahui pengaruhnya terhadap tingkat keparahan dari kerusakan hepar melalui gambaran histopatologinya.
BAHAN DAN METODE
Persiapan Hewan Coba
Hewan coba diadaptasi terhadap lingkungan selama tujuh hari dengan pemberian pakan berupa pakan ayam buras dewasa dari Wonokoyo Jaya Corpindo dan minum ad libitum pada semua tikus. Hewan model dibagi menjadi lima kelompok perlakuan, yaitu : kelompok kontrol negatif (P0), kelompok kontrol positif diabetes mellitus tipe 1 (P), kelompok DM 1 yang diterapi ekstrak etanol rimpang kunyit 1,2 g/kgBB (P2), kelompok DM 1 yang diterapi ekstrak etanol rimpang kunyit 1,8 g/kgBB (P3), dan kelompok DM 1 yang diterapi ekstrak etanol rimpang kunyit 2,7 g/kgBB (P4).
Pembuatan Hewan Model Diabetes Mellitus Tipe 1
Seminggu pasca adaptasi, dilakukan pengukuran kadar gula darah dengan menggunakan glukometer pada semua kelompok perlakuan. Pemberian injeksi streptozotocin (STZ) pada kelompok P1, P2, P3, dan P4 dengan dosis 20 mg/kgBB selama lima hari berturut – turut, injeksi dilakukan dengan rute intraperitoneal (IP). Pada proses diabetes mellitus, dilakukan pengukuran kadar gula darah tiap tujuh hari sekali untuk memastikan tikus telah mengalami kenaikan kadar gula darah. Kadar gula darah normal pada tikus adalah 126 mg/dL (Barik et al., 2008). Hasil pengukuran pada tikus model diabetes mellitus tipe 1 pada penelitian ini terjadi kenaikan kadar gula darah >600 mg/dL, maka dipastikan bahwa sampel tikus tersebut telah menderita diabetes mellitus pada hari ke-14 setelah pemberian STZ.
Pembuatan Ekstrak Etanol Rimpang Kunyit
Pembuatan ekstrak etanol rimpang kunyit dengan menggunakan metode maserasi, tahapannya dimulai dengan mencuci bersih kunyit dan dipotong tipis – tipis, kemudian dimasukkan oven dengan suhu 40-60°C hingga kunyit kering. Tahapan selanjutnya yaitu proses ekstraksi, kunyit yang telah kering dihaluskan dengan blender sampai halus, ditimbang sebanyak 100 gram dan dimasukkan ke dalam gelas erlenmeyer ukuran 1 liter. Kunyit kering tersebut ditambahkan dengan etanol 96% sampai menjadi 1 liter dan dikocok hingga benar – benar tercampur. Rendaman kunyit dan etanol didiamkan selama satu hari hingga mengendap, kemudian diambil lapisan atas campuran etanol (pelarut) dengan zat aktif yang sudah tercampur dengan penyaringan menggunakan kertas saring. Larutan campuran etanol dan zat aktif kunyit tersebut kemudian dievaporasi menggunakan penangas air dengan suhu 80°C hingga ekstrak menjadi kental dan ditimbang berat ekstraknya, kemudian di evaporasi kembali dengan menggunakan oven untuk menghilangkan etanol yang tersisa. Evaporasi dengan oven dengan suhu 70°C, setiap 15 menit ekstrak ditimbang hingga tiga kali penimbangan berat ekstrak yang sama. Ekstrak kunyit yang telah dievaporasi diencerkan dengan akuades dan Na2CO3 agar mudah untuk disondekan.
Pemberian Terapi Hewan Model
Pemberian perlakuan terapi ekstrak etanol rimpang kunyit dimulai pada hari ke-15 setelah pemberian STZ. Terapi ekstrak etanol rimpang kunyit (Curcuma Longa L.) diberikan pada kelompok P2, kelompok P3, dan kelompok P4. Pemberian terapi dilakukan secara per oral melalui sonde lambung dengan dosis ekstrak etanol rimpang kunyit sesuai dengan kelompok. Pemberian terapi rutin dilakukan sehari sekali selama 42 hari. Selama pemberian terapi, dilakukan pengukuran kadar gula darah setiap tujuh hari sekali pada semua kelompok perlakuan.
Perhitungan kadar LDL
Pengambilan serum darah dilakukan pada tikus pada hari ke-42. Dilakukan eutanasi dengan cara dislokasi leherpada tikus pada bagian leher. Pembedahan dilakukan untuk mengambil darah sebanyak 5 mL dari jantung. Darah ditempatkan dalam tabung reaksi dalam keadaan miring dan didiamkan ± 4 jam. Selanjutnya serum yang keluar diambil dengan mikropipet dan dipindahkan ke ependorf kemudian disentrifugasi dengan kecepatan 3000 rpm selama 10 menit.
Pengukuran kadar kolesterol dengan menggunakan metode direct dan dibaca dengan spektofotometer. Kemudian diukur dengan panjang gelombang 550 nm.
Pengamatan perlemakan Hepar
Hepar diambil saat pemedahan tikus di bagian abdomen cranio-lateral dexter. Selanjutnya hepar disimpan dalam larutan paraformaldehid (PFA) 4% untuk pembuatan preparat histologi.Hasil pembuatan preparat histopatologi hepar menggunakan mikroskop cahaya Olympus BX51 dengan perbesaran 100 kali dilanjutkan dengan perbesaran 400 kali untuk melihat secara histopatologi adanya kerusakan sel hepar yang mengakibatkan bergesernya inti sel oleh lemak.
Analisis Data
Analisa data histopatologi kerusakan sel hepar dilakukan secara kualitatif deksriptif. Kadar Low Density Lipoprotein (LDL) dihitung dengan metode direct dan dibaca dengan spektrofotometer, dilakukan secara kuantitatif dengan menggunakan ANOVA dan apabila terdapat perbedaan perlakuan nyata, maka perbedaan nilai tengah diuji dengan pembandingan berganda uji Tukey atau Beda Nyata Jujur (BNJ) α = 0.05.
HASIL DAN PEMBAHASAN
Kadar Low Density Lipoprotein pada hewan tikus model diabetes mellitus tipe 1 dengan terapi ekstrak etanol kunyit (Curcuma Longa L) terhadap kadar LDL
Pengujian kadar Low Density Lipoprotein (LDL) dengan metode direct pada penelitian ini dilakukan bertujuan untuk mengetahui pengaruh terapi ekstrak etanol kunyit (Curcuma Longa L) terhadap tikus model DM tipe 1. Analisis perhitungan kadar LDL pada tikus (Rattus norvegicus) jantan strain wistar dilakukan dengan menggunakan ANOVA dan didapatkan hasil pengukuran yang berbeda (p<0,05) antar kelompok perlakuan, kemudian dilanjutkan dengan uji Tukey untuk melihat perbedaan yang dinyatakan dengan notasi huruf. Hasil pengukuran kadar LDL dapat dilihat pada Tabel 1.
Tabel 1. Data Perhitungan Rata-rata Kadar Lemak LDL

Perbedaan kadar LDL antara tikus kelompok P0 dan tikus kelompok P1 menunjukkan hasil yang signifikan (p0,05) apabila dibandingkan dengan kelompok P2 dan tikus kelompok P3 (20,54±2,09) yaitu tikus DM 1. Kondisi ini ditandai dengan penurunan kadar LDL kelompok P2 dan kelompok P3 terhadap kelompok P1 secara berturut-turut yaitu 16,83% dan 27,34%. Hal tersebut menunjukkan bahwa ekstrak etanol kunyit belum mampu berperan sebagai antioksidan untuk menurunkan radikal bebas. Tikus kelompok P4 ika dibandingkan dengan tikus kelompok menunjukkan hasil yang signifikan (p<0,05). Hal ini menunjukkan bahwa dengan dosis terapi ekstrak etanol kunyit dosis 2,7 g/kg BB telah mampu menurunkan kadar radikal bebas di dalam tubuh sehingga kadar LDL menurun hingga mencapai 59,55 %.
Diabetes Mellitus (DM) tipe 1 merupakan suatu penyakit metabolik dengan karakteristik hiperglikemia (gula dalam darah tinggi) karena gangguan sekresi insulin akibat kerusakan sel β pankreas. Keadaan DM akan menyebabkan metabolisme karbohidrat dan lemak terganggu. Gangguan sekresi insulin terjadi karena disebabkan adanya radikal bebas akibat induksi STZ yang mampu meningkatkan oksigen reaktif yang mempunyai peran tinggi terhadap kerusakan sel β pankreas (Nugroho, 2006). Terjadinya kekurangan insulin akan mengakibatkan sumber energi diambil dari katabolisme Free Fatty Acid (FFA) sehingga FFA terus meningkat dalam darah. Free Fatty Acid (FFA) yang berlebihan juga meningkatkan pengubahan beberapa asam lemak menjadi fosfolipid dan kolesterol di hepar (Ganong, 2002). Kolestrol yang tinggi pada hepar akan mengakibatkan proses clearance LDL dalam darah mengalami penurunan dan menyebabkan peningkatan LDL dalam darah (Bothan and Mayes, 2009).
Kunyit diketahui mengandung senyawa antioksidan yang tinggi yaitu kurkumin. Hal ini sesuai dengan Sharma (2005) yang menunjukkan bahwa kurkumin yang terkandung dalam kunyit dapat berperan sebagai antioksidan. Kurkumin yang berperan sebagai antioksidan akan menstabilkan radikal bebas sehingga dapat menghambat kerusakan sel β pankreas dan merangsang sekresi insulin. Kurkumin juga berperan untuk menurunkan kadar kolesterol sesuai dengan Lennernas and Fager (1997), yang menjelaskan bahwa kurkumin mampu menurunkan kadar kolesterol dengan menstimulasi aktivitas enzim hepatic cholesterol-7α-hydroxylase. Enzim yang terdapat di dalam sel hepar ini akan mengkatalisasi perubahan kolesterol menjadi asam empedu. Akibat stimulasi enzim ini oleh kurkumin maka perubahan kolesterol hepatik menjadi asam empedu meningkat, akibatnya kadar kolesterol di dalam hepar berkurang. Hal ini dapat mempengaruhi kenaikan jumlah reseptor LDL pada hepar untuk memenuhi kebutuhan kolestrol sehingga terjadi peningkatan pengambilan LDL dalam darah yang akan disertai dengan penurunan kadar kolesterol LDL dalam darah.
Gambaran histopatologi hepar hewan model tikus diabetes mellitus tipe 1 dengan terapi ekstrak etanol kunyit (Curcuma longa L) terhadap gambaran histologi hepar
Kerusakan hepar tikus model diabetes mellitus 1 dapat dilihat melalui pewarnaan Hematoksilin Eosin (HE) (Gambar 1). Kerusakan hepar ditandai dengan adanya perlemakan. Metode pewarnaan HE akan membuat lemak pada jaringan luruh pada proses pembuatan preparat, sehingga ketika diamati lemak pada jaringan akan terlihat sebagai bagian yang kosong (tidak terwarnai).
Jaringan hepar tikus (pewarnaan HE) pada kelompok kontrol negatif kelompok P0 menunjukkan gambaran histologi normal. Jaringan hepar tikus kelompok P1, P2, P3 terlihat sel hepar yang mengalami perlemakan. Perlemakan ditandai dengan adanya akumulasi trigliserida pada
sitoplasma berupa vakuola jernih dalam sitoplasma (Sudiono, 2003). Pemberian terapi ekstrak etanol kunyit pada tikus kelompok P2 menunjukkan adanya perbaikan berupa penurunan lemak pada sel hepar dibandingkan dengan tikus kelompok P1. Sedangkan pada tikus kelompok P3 penurunan lemak pada sel hepar semakin jelas. Pada tikus kelompok P4 terlihat penurunan lemak pada sel hepar yang menunjukkan telah mendekati normal.
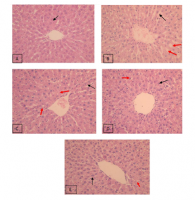
Gambar 1. Gambaran histopatologi hepar tikus (Rattus norvegicus).
Keterangan: Pewarnaan HE. Perbesaran 400 kali. (A) kontrol negatif. (B) kontrol positif.
(C) terapi 1,2 g/kg BB. (D) terapi 1,8 g/kg BB. (E) terapi 2,7 g/kg BB. Panah merah ( ) menunjukkan vakuola lemak. Panah hitam ( menunjukkan sel hepar normal. VS menunjukkan vena sentralis.
Gangguan metabolisme karbohidrat dan lemak terjadi pada tikus yang menderita DM 1. Gangguan metabolisme tersebut terjadi karena adanya gangguan kerja hormon insulin di dalam tubuh. Gangguan sekresi hormon insulin diakibatkan adanya kerusakan sel β pankreas yang berperan untuk memproduksi insulin. Timbulnya kerusakan sel β pankreas tersebut disebabkan peningkatan radikal bebas akibat pemberian streptozotocin (STZ) yang menyebabkan penurunan produksi insulin yang akan mengakibatkan gangguan metabolisme lemak yang mengakibatkan terjadinya peningkatan trigliserida (TG) serta kolesterol. Penelitian yang dilakukan Kagate et al. (2008) menunjukkan bahwa insulin dimediasi FoxO1 beraksi pada MTP hati dalam pengaturan produksi VLDL dan metabolisme TG.
Menurut yang dijelaskan Botham and Mayes (2009) bahwa penurunan insulin mengakibatkan kerja Hormone Sensitive Lipase (HSL) meningkat dan penurunan kerja enzim Lipoprotein Lipase (LPL). Hormone Sensitive Lipase berfungsi menghidrolisis TG dalam sel adiposa menjadi Free Fatty Acid (FFA) dan gliserol. Jika peningkatan HSL terjadi akibat penurunan insulin maka akan menyebabkan peningkatan hidrolisis TG menjadi FFA dan gliserol pada jaringan adiposa. Akibatnya FFA dalam darah akan meningkat dan selanjutnya akan menuju hepar untuk diesterifikasi menjadi TG. Timbunan TG pada hepar yang dapat menyebabkan kerusakan sel hepar akan terjadi jika jumlah FFA yeng menuju hepar melebihi kemampuan hepar (Angulo, 2002).
Sementara itu penurunan aktivitas enzim LPL akibat penurunan insulin ini berefek penghambatan pengeluaran TG dari hepar, mengakibatkan TG terakumulasi di dalam hepar dan menghasilkan perlemakan hepar. Penelitian Oktaviana (2005), menjelaskan bahwa adanya penumpukan lemak pada sel hepar menyebabkan terjadinya perubahan susunan sel dan menyebabkan bentuk sinusoid tampak melebar.
Berdasarkan hal-hal di atas untuk menghambat radikal bebas akibat pemberian STZ dibutuhkan suatu antioksidan. Antioksidan adalah substansi yang diperlukan tubuh untuk menetralisir radikal bebas. Antioksidan menetralisir radikal bebas dengan melengkapi kekurangan elektron yang dimiliki radikal bebas (Gusti, 2013). Menurut Kohli et al (2004), aktivitas kurkumin sebagai antioksidan cukup kuat sehingga diharapkan kurkumin dapat menghambat radikal bebas dan menghambat kerusakan sel beta pankreas. Peningkatan insulin akan menurunkan aktivitas HSL dan peningkatan kerja enzim LPL. Apabila aktivitas HSL menurun maka hidrolisis TG menjadi FFA dan gliserol pada jaringan adiposa mengalami penurunan sehingga FFA dalam darah akan menurun yang akan berdampak penurunan esterikasi FFA menjadi TG pada hepar sedangkan peningkatan aktivitas enzim LPL dapat membantu pengeluaran TG dari hepar. Hal tersebut akan mengurangi TG yang menumpuk pada hepar sehingga mengurangi perlemakan hepar.
KESIMPULAN
Pemberian ekstrak etanol kunyit (Curcuma longa L) dengan dosis 2,7 g/kg BB dapat menurunkan kadar Low Density Lipoprotein (LDL) pada tikus model diabetes mellitus tipe 1 sebanyak 59,55% serta dapat menurunkan keparahan dari perlemakan hepar tikus model diabetes mellitus 1 yang ditunjukkan dengan berkurangnya vakuola lemak.
UCAPAN TERIMA KASIH
Penelitian ini merupakan bagian dari penelitian yang dibiayai oleh dana BOPTN Universitas Brawijaya.
DAFTAR PUSTAKA
Angulo, 2002. Nonalcoholic fatty liver disease. N Engl J Med 2002; 3469(16): 1221-31.
Barik, R., S. Jain, D. Qwatra, A. Joshi, G.S. Tripathi and R. Goyal. 2008. Antidiabetic activity of aqueous root extract of Ichnocarpus frutescens in streptozotocin-nicotinamide induced type II diabetes in rats. Indian Journal of Pharmacology 40(1): 19-22.
Botham, K.M., and Mayes, P.A., 2009. Pengangkutan dan Penyimpanan Lipid. Jakarta: EGC. Hal: 225-238.
Fall, T.,Hamlin, H.H., Hedhammar, A., Kampe, O., and Egenvall, A., 2007. Diabetes Mellitus in a Population of 180.000 Insured Dogs: Incidence, Survival, and Breed Distribution. J Vet Intern Med 21:1209-1216.
Ganong, William. F. 2002. Buku Ajar Fisiologi Kedokteran ; editor edisi bahasa indonesia, H.M. Djauhari Widjajakusumah-ed.20. EGC. Jakarta.
Gusti, I. A. 2013. Suplementasi Kombinasi Tempe M-2 dengan Wortel (Daucus carrota) Meningkatkan HDL dan Antioksidan Total, serta Menurunkan LDL, F2-isoprostan dan IL-6 pada Tikus Wistar Aterosklerosis [Disertasi]. Program Pascasarjana. Universitas Udayana.
Hoenig, M. 2002. Comparative Aspects of Diabetes Mellitus in Dogs and Cats.
Molecular and Endocrinology 197 : 221-229.
Kamagate A, Shen Qu, German P, Dongming Su, Dae Hyun Kim, Sandra S, Marcia M, and Henry D. 2008. FoxO1 mediates insulin-dependent regulation of hepatic VLDL production in mice. J Clin Invest. 2008;118(6):2347-2364
Kohli K., Ali J., Ansari M.J., and Raheman Z. 2004. Curcumin: A Natural Antiinflammatory Agent. Indian Jurnal of Pharmacology. 37(3): 141-147
Lennernas H, Fager G. (1997). Pharmacodynamics and Pharmacokinetics of the HMG-CoA Reductase Inhibitors. Clin. Pharmacokinet 1997; 403-425.
Mayfield J. 1998. Diagnosis and classification of diabetes mellitus : new criteria. American Family Phyician 58 (6) : 1-8
Nugroho, A. E. 2006. Animals Models Of Diabetes mellitus: Pathology and Mechanism Of Some Diabetogenics. Laboratorium Farmakologi Dan Toksikologi, Bagian Farmakologi dan Farmasi Klinik, Fakultas Farmasi Universitas Gajah Mada Yogyakarta.
Priyadarsini, K.I., Maity, D.K., Naik, G.H., Kumar, M.S., Unnikrishnan, M.K., Satav, J.G., dan Mohan, H. 2003. Role of Phenolic OH And Methylene Hydrogen On The Free Radical Reactions And Antioxidant Activity of Curcumin. Free Radical Biology And Medicine, 35(5): 475–484.
Setiawan, B., dan Ernawati. 2007. Efek Proteksi dari Curcumin Terhadap Sel Endothelium pada Stress. Department Of Pharmacology, Faculty of Medicine Wijaya Kusuma University, Surabaya.
Wijaya A. Parameter Risiko Penyakit Vaskuler Aterosklerotik Koroner dan Serebral. Forum Diagnosticum. 1995; 3: 1-15.
Sharma, R.A., A. J. Gescher, W. P. Steward. 2005. Curcumin: The Story So Far. European Journal of Cancer, 41:1955–1968.
Sudiono, J. B., Kurniadhi, Hendrawan, A., dan Djinantoro, B. 2003.Patologi. Penerbit EGC. Jakarta
LINK JURNAL: http://jitek.ub.ac.id/index.php/jitek/article/view/217
1. KADAR LOW DENSITY LIPOPROTEIN DAN GAMBARAN HISTOPATOLOGI HEPAR 1
